雅典大学的Areti Strati团队首次验证了微滴数字PCR(ddPCR)用于检测CTC上PD-L1表达水平的可能性,该研究结果于2021年发表在《Clinical Chemistry》杂志上。该团队分别用ddPCR和qPCR对71例头颈癌患者CTC上的PD-L1转录水平进行检测和对比,验证了ddPCR是一种具有高灵敏度、高特异度、高重现性的检测方式。ddPCR可以对CTC中的PD-L1进行绝对定量,提高检验灵敏度,在临床上可以对接受免疫治疗的患者的病情进行更精确的动态监控。

微滴数字PCR(ddPCR)优秀的灵敏度和稳定性使其在液体活检领域中有着极大的潜力。传统PCR对样本内的拷贝数进行定量时,需要先创建标准曲线,再将待测样本与标准曲线进行对比后推断出数值,任何操作上的小错误都会极大影响检测结果的准确度,对技术人员的要求较高。然而ddPCR在不需要依赖标准曲线的同时,还可以在拷贝数极低、背景嘈杂的情况下对样本进行绝对定量,尤其适用于对低浓度样本中的低频突变进行检测,操作难度也大幅降低。尽管ddPCR相较qPCR有着巨大优势,目前为止使用ddPCR对CTC基因进行检测的研究并不多。
该项研究中,研究者们开发并验证了一种具有高灵敏度、高特异性、高重现性的ddPCR检测方案,可以对CTC内的PD-L1和HPRT(内参)转录物同时进行量化,并且评估了这个方案在头颈癌临床应用中的价值。在对PD-L1和HPRT的ddPCR 检测方案进行开发和分析验证时发现,60°C是最佳的退火温度。在这个温度下,阳性液滴的荧光强度最高、被检测出的拷贝数最多、雨滴(rain drop)最少、阳性和阴性的液滴区分最明显、PD-L1拷贝数/HPRT拷贝数比例最高。同时,该方案又进一步优化了引物和探针的浓度。
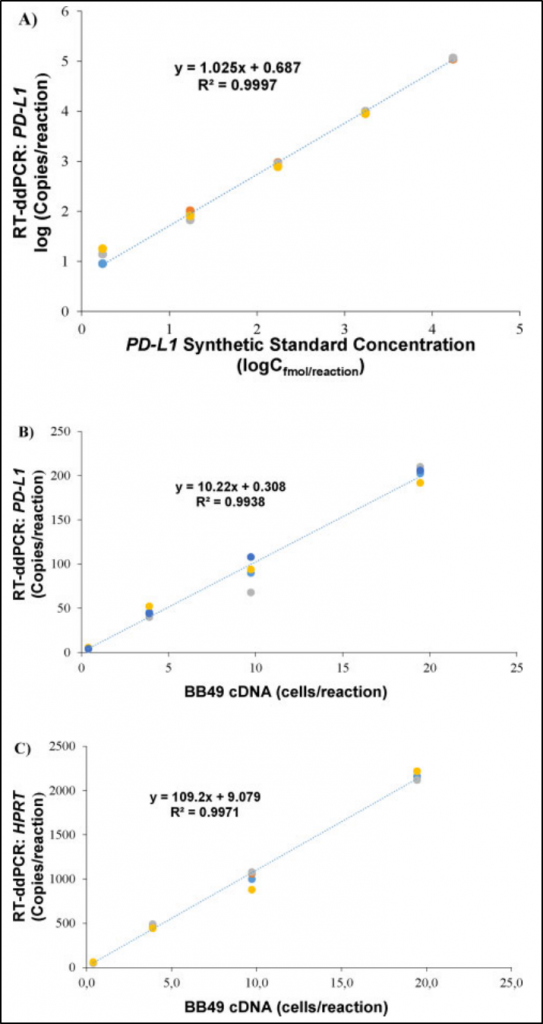
ddPCR检测PD-L1和HPRT标准曲线的线性关系
研究者评估了4种细胞浓度下(20,10,4,0.4个细胞/反应)ddPCR检测PD-L1和HPRT转录的批间重现性。每种浓度的稀释物中PD-L1/HPRT比例都较稳定。PD-L1的CV%为4.75%-23%,HPRT的CV%为2.7%-11%。PD-L1和HPRT的L-J质控曲线表明该ddPCR检测方案有着高重现性。
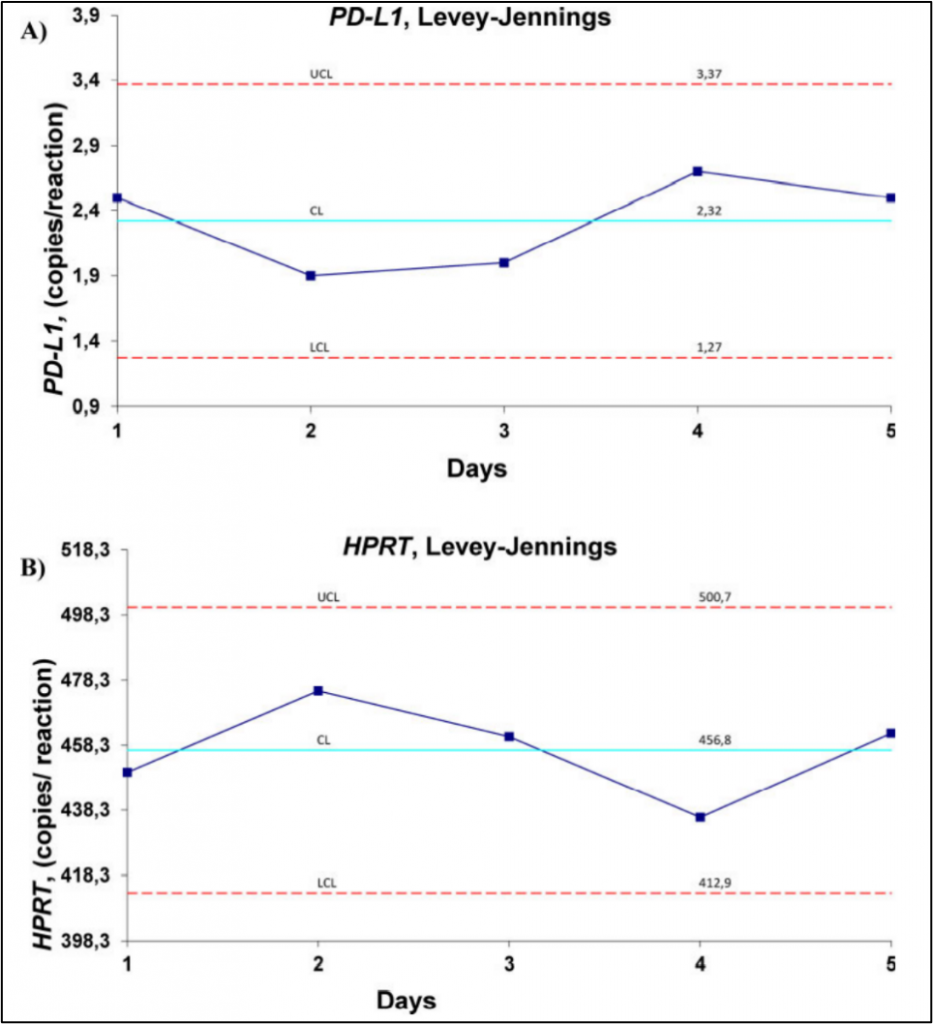
ddPCR批间重现性实验:Levey-Jennings质控曲线
研究者用ddPCR对71个头颈癌患者样品中的cDNA进行绝对定量,cDNA均来自于患者血液中的CTC。71个样本中有33个样本(46.5%)被检测出PD-L1阳性。在健康人组中,PD-L1的拷贝/反应中位数为2.7(0-3.6),头颈癌患者的CTC PD-L1拷贝/反应中位数则为6.85(0-179),该分布具有统计学显著差异(P=0.018)。然而,qPCR在71份样品中只检测出了21位(32.4%)患者为PD-L1阳性。同时,在qPCR检测结果中,健康人与头颈癌患者的PD-L1表达倍数变化没有显著差异(0.315)。
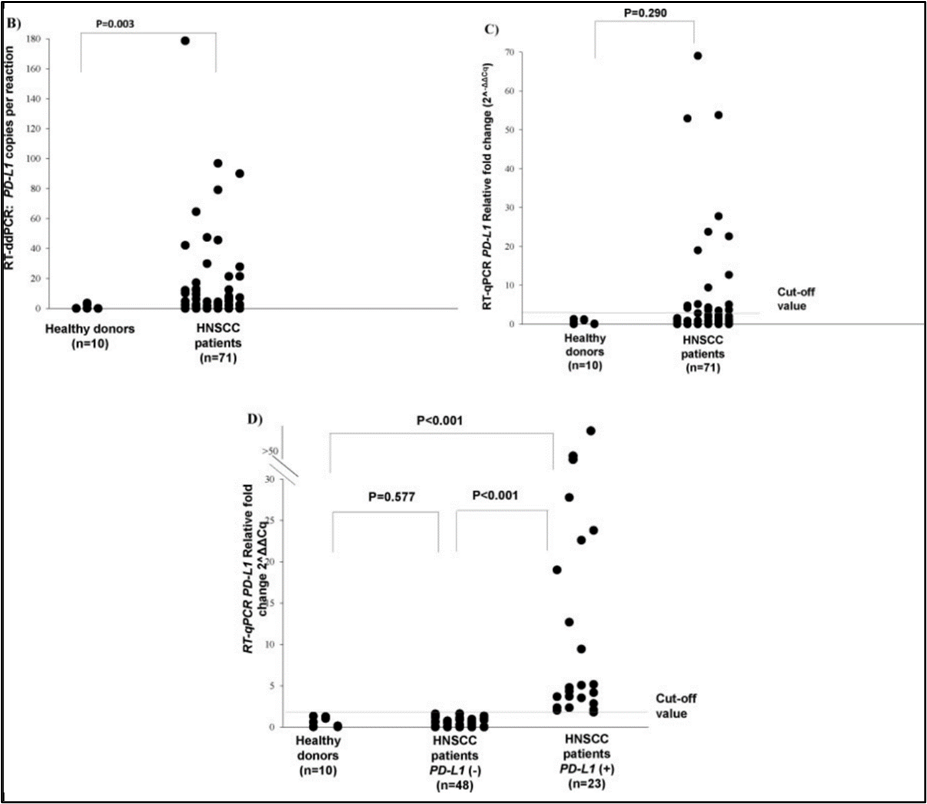
ddPCR和qPCR检测结果比对
研究者将头颈癌患者的血液标本分为PD-L1阴性,PD-L1阳性两组。用qPCR检测时,阳性组的PD-L1倍数变化中位数为4.79,阴性为0.26,出现显著差异(P<0.001)。再将PD-L1阳性患者PD-L1表达情况与健康人进行比对,倍数变化也出现显著差异(P<0.001)。PD-L1阴性患者检测结果和健康人没有显著差异(P=0.577)。ddPCR在77.5%的患者(55/71)检测结果与qPCR一致:35/71(49.3%)个样本被qPCR和ddPCR一致判定为PD-L1阴性,20/71(28.2%)个样本被两者判定为阳性。此外,3/71(4.2%)个样本被qPCR检测出阳性而未被ddPCR检测到,13/71(18.3%)个样本被ddPCR检测为阳性,然而未被qPCR检测到。
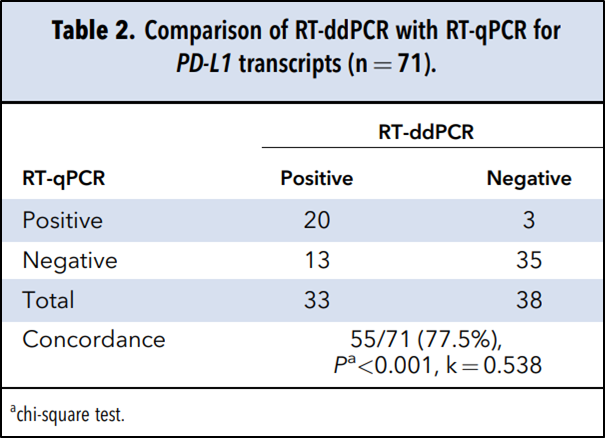
ddPCR和qPCR检测PD-L1转录情况比对(n=71)
总结:该团队研发并且验证了一种可以运用于液体活检中的ddPCR检测方案,可以对CTC中的PD-L1和HPRT进行量化。该研究数据显示,ddPCR比RT-qPCR具有更好的敏感性。这是首次使用ddPCR对CTC内的PD-L1表达进行绝对定量的研究,该研究结果表明,ddPCR具有筛选患者以及预判PD-1/PD-L1免疫治疗疗效的临床价值,有望被用于实时监测接受免疫治疗的癌症患者的CTC。
作者:孟静嘉 校对:陈松峰
参考文献:
[1] Development and Analytical Validation of a Reverse Transcription Droplet Digital PCR (RT-ddPCR) Assay for PD-L1 Transcripts in Circulating Tumor Cells. Clin Chem. 2021;67(4):642-652.
